Blog
LA NANOTECHNOLOGIE ET L’OXYDE DE GRAPHÈNE : L’AVENIR DE LA RECHERCHE VACCINALE
Une Exploration Scientifique Approfondie de l’Innovation Mondiale
1. Introduction à la Nanotechnologie en Médecine

Figure 1 : Scientifiques travaillant dans un laboratoire de recherche moderne équipé des dernières technologies
La nanotechnologie représente l’une des révolutions scientifiques les plus prometteuses du XXIe siècle. Définie comme la manipulation de la matière à l’échelle atomique et moléculaire, cette discipline opère dans la gamme de 1 à 100 nanomètres, soit environ 80 000 fois plus petit que l’épaisseur d’un cheveu humain. Dans le domaine médical, cette technologie ouvre des perspectives extraordinaires qui transforment radicalement notre approche du diagnostic, du traitement et de la prévention des maladies.
L’histoire de la nanotechnologie médicale remonte aux années 1950, lorsque le physicien Richard Feynman a prononcé sa célèbre conférence « There’s Plenty of Room at the Bottom », imaginant un monde où les scientifiques pourraient manipuler la matière atome par atome. Cependant, ce n’est qu’à partir des années 1980 que les premiers outils permettant d’observer et de manipuler les structures nanométriques ont été développés, notamment le microscope à effet tunnel et le microscope à force atomique.
Les applications médicales actuelles de la nanotechnologie sont déjà impressionnantes. Les nanoparticules sont utilisées comme agents de contraste en imagerie médicale, permettant une visualisation plus précise des tissus et des organes. En oncologie, les nanoporteurs permettent de délivrer les médicaments de chimiothérapie directement aux cellules cancéreuses, réduisant ainsi les effets secondaires sur les tissus sains. Les nanocapteurs révolutionnent le diagnostic précoce en détectant des biomarqueurs de maladies à des concentrations infimes.
Dans le contexte du développement vaccinal, la nanotechnologie présente des avantages considérables. Les nanoparticules peuvent servir de véhicules pour transporter les antigènes vaccinaux de manière ciblée vers les cellules immunitaires appropriées. Elles permettent également de contrôler la libération des antigènes dans le temps, prolongeant ainsi la stimulation immunitaire. Cette approche promet de créer des vaccins plus efficaces, nécessitant des doses plus faibles et offrant une protection plus durable.
L’intégration de la nanotechnologie dans la recherche vaccinale s’inscrit dans une démarche d’innovation globale où convergent physique, chimie, biologie et médecine. Cette interdisciplinarité est essentielle pour relever les défis sanitaires contemporains, notamment l’émergence de nouvelles maladies infectieuses et la nécessité de développer des vaccins personnalisés pour différentes populations.
2. Qu’est-ce que l’Oxyde de Graphène ?

Figure 2 : Images de microscopie électronique à transmission (MET) de flocons d’oxyde de graphène montrant leur structure bidimensionnelle unique
L’oxyde de graphène (GO) représente l’un des nanomatériaux les plus fascinants de la recherche contemporaine. Il s’agit d’un dérivé oxydé du graphène, ce matériau bidimensionnel composé d’une seule couche d’atomes de carbone arrangés en structure hexagonale, semblable à un nid d’abeille. Cette structure unique confère à l’oxyde de graphène des propriétés exceptionnelles qui suscitent un intérêt croissant dans de nombreux domaines scientifiques.
La découverte du graphène remonte à 2004, lorsque Andre Geim et Konstantin Novoselov de l’Université de Manchester ont réussi à isoler une couche unique d’atomes de carbone à partir de graphite en utilisant une technique aussi simple qu’ingénieuse : le « scotch tape method ». Cette découverte leur a valu le prix Nobel de physique en 2010. L’oxyde de graphène, quant à lui, avait été synthétisé bien avant, dès 1859 par le chimiste britannique Benjamin Brodie, mais ses propriétés remarquables n’ont été pleinement comprises qu’avec l’avènement des nanotechnologies modernes.
Au niveau moléculaire, l’oxyde de graphène se distingue par la présence de nombreux groupes fonctionnels oxygénés, notamment des groupes hydroxyle, époxy et carboxyle, greffés sur le réseau carboné. Ces groupes fonctionnels confèrent au matériau des propriétés hydrophiles, contrairement au graphène pristine qui est hydrophobe. Cette caractéristique est cruciale pour les applications biomédicales car elle permet une meilleure dispersion dans les milieux aqueux biologiques.
Les propriétés uniques de l’oxyde de graphène incluent sa grande surface spécifique, pouvant atteindre plus de 2600 m²/g, sa flexibilité mécanique remarquable et sa biocompatibilité relative. Sa structure bidimensionnelle lui permet d’interagir efficacement avec les biomolécules, tandis que sa capacité à être fonctionnalisé chimiquement ouvre la voie à de nombreuses applications sur mesure. De plus, l’oxyde de graphène présente des propriétés optiques et électroniques modulables, particulièrement intéressantes pour le développement de biosenseurs.
L’intérêt de la recherche médicale pour l’oxyde de graphène s’explique par plusieurs facteurs. Premièrement, sa grande surface permet de charger une quantité importante de médicaments ou d’antigènes. Deuxièmement, sa capacité à traverser les membranes cellulaires facilite la délivrance intracellulaire de substances actives. Troisièmement, sa possibilité de fonctionnalisation permet de cibler spécifiquement certains types cellulaires. Enfin, ses propriétés antimicrobiennes intrinsèques ajoutent une dimension thérapeutique supplémentaire.
Dans le contexte vaccinal, l’oxyde de graphène présente un potentiel particulièrement prometteur comme adjuvant et système de délivrance. Sa capacité à stimuler le système immunitaire inné, couplée à ses propriétés de transport, en fait un candidat idéal pour améliorer l’efficacité des vaccins de nouvelle génération. Cependant, comme pour tout nouveau matériau biomédical, son développement nécessite des études approfondies de sécurité et d’efficacité.
3. Recherche Actuelle sur le Graphène comme Adjuvant Vaccinal
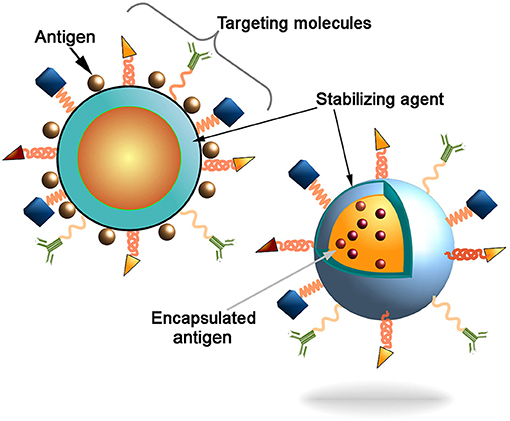
Figure 3 : Schéma illustrant les différents systèmes de délivrance de vaccins à nanoparticules et leurs mécanismes d’action
Les adjuvants vaccinaux constituent un élément fondamental de l’immunologie moderne. Ces substances, ajoutées aux vaccins, ont pour fonction de renforcer, moduler et prolonger la réponse immunitaire spécifique contre l’antigène vaccinal. Historiquement, les sels d’aluminium ont dominé ce domaine pendant plus de 90 ans, mais l’émergence de nouveaux défis sanitaires et l’évolution des connaissances immunologiques ont créé un besoin urgent de développer des adjuvants de nouvelle génération plus efficaces et mieux tolérés.
L’oxyde de graphène émerge comme un candidat adjuvant particulièrement prometteur grâce à ses propriétés immunostimulantes uniques. Les recherches récentes menées dans plusieurs laboratoires internationaux démontrent que ce nanomatériau possède la capacité remarquable d’activer simultanément plusieurs voies de l’immunité innée. Cette activation multipiste représente un avantage considérable par rapport aux adjuvants traditionnels qui ne ciblent généralement qu’une seule voie de signalisation immunitaire.
Les études précliniques révèlent que l’oxyde de graphène peut considérablement améliorer l’efficacité vaccinale par plusieurs mécanismes complémentaires. Tout d’abord, sa structure bidimensionnelle unique lui permet de servir de plateforme de présentation antigénique, concentrant les antigènes vaccinaux sur une grande surface accessible aux cellules immunitaires. Cette présentation optimisée favorise la reconnaissance et la capture des antigènes par les cellules dendritiques, véritables orchestrateurs de la réponse immunitaire adaptative.
Les recherches menées sur les cellules dendritiques, ces sentinelles du système immunitaire responsables de l’initiation de la réponse immune spécifique, montrent des résultats particulièrement encourageants. Lorsque les cellules dendritiques entrent en contact avec l’oxyde de graphène, elles subissent une maturation accélérée caractérisée par l’expression accrue de molécules de costimulation et la production de cytokines pro-inflammatoires. Cette maturation enhanced améliore significativement leur capacité à présenter les antigènes aux lymphocytes T et à initier une réponse immunitaire robuste et durable.
La stimulation de la réponse immunitaire par l’oxyde de graphène implique plusieurs voies moléculaires sophistiquées. Les recherches indiquent que ce nanomatériau peut activer les récepteurs Toll-like (TLR), notamment TLR4, déclenchant une cascade de signalisation qui aboutit à la production d’interleukines pro-inflammatoires comme IL-1β, IL-6 et TNF-α. Parallèlement, l’oxyde de graphène semble capable d’activer l’inflammasome NLRP3, un complexe protéique intracellulaire crucial pour la maturation de l’IL-1β, cytokine clé de l’immunité innée.
Une caractéristique particulièrement intéressante de l’oxyde de graphène réside dans sa capacité à induire une réponse immunitaire équilibrée, favorisant à la fois l’immunité humorale (production d’anticorps) et l’immunité cellulaire (activation des lymphocytes T cytotoxiques). Cette double activation est essentielle pour une protection vaccinale optimale, particulièrement importante dans le contexte des maladies infectieuses émergentes où une réponse immunitaire multifacette est nécessaire pour assurer une protection durable et efficace contre les pathogènes en constante évolution.
4. Nanoparticules Lipidiques dans les Vaccins Modernes
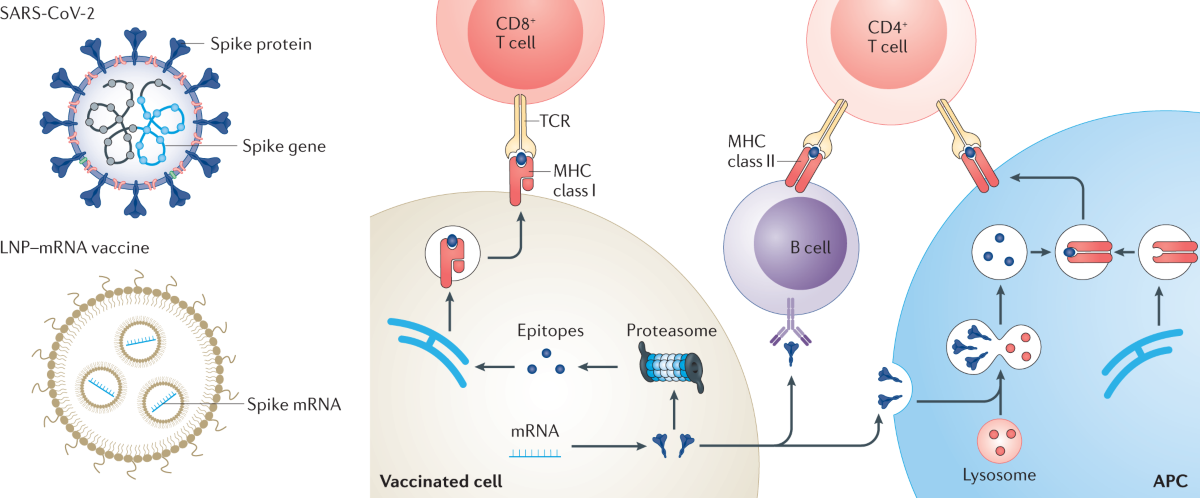
Figure 4 : Structure détaillée des nanoparticules lipidiques (LNP) utilisées dans les vaccins ARNm modernes
L’histoire des nanoparticules lipidiques (LNP) dans le développement pharmaceutique remonte au début des années 1990, marquant une révolution dans la délivrance de médicaments. Ces systèmes de vectorisation, initialement développés comme alternative aux émulsions et aux liposomes conventionnels, ont trouvé leur application la plus spectaculaire dans les vaccins ARNm qui ont transformé la réponse mondiale à la pandémie de COVID-19. Cette technologie représente l’aboutissement de trois décennies de recherche intensive en nanomédecine et en biotechnologie.
Les nanoparticules lipidiques constituent le véritable « cheval de Troie » des vaccins ARNm modernes. Leur fonction principale consiste à encapsuler et protéger l’ARN messager fragile contre la dégradation par les enzymes naturelles de l’organisme, tout en facilitant son transport vers les cellules cibles. Cette protection est cruciale car l’ARNm nu est rapidement dégradé par les RNases ubiquitaires présentes dans tous les fluides biologiques, rendant impossible toute application thérapeutique sans système de vectorisation approprié.
Le fonctionnement des nanoparticules lipidiques repose sur un mécanisme sophistiqué d’endocytose cellulaire suivi d’une libération cytoplasmique contrôlée. Après injection, ces nanoparticules de 80 à 200 nanomètres de diamètre sont rapidement internalisées par les cellules via plusieurs mécanismes d’endocytose, incluant la macropinocytose et l’endocytose médiée par les récepteurs. Une fois dans la cellule, l’environnement acide des endosomes déclenche un changement conformationnel des lipides ionisables, provoquant la déstabilisation de la membrane endosomale et la libération de l’ARNm dans le cytoplasme.
Le succès retentissant des vaccins COVID-19 développés par Pfizer-BioNTech (BNT162b2) et Moderna (mRNA-1273) a démontré de manière éclatante le potentiel révolutionnaire de cette technologie. Ces vaccins, développés en un temps record de moins de 11 mois, ont montré une efficacité supérieure à 90% dans la prévention de la maladie symptomatique, surpassant les attentes les plus optimistes de la communauté scientifique. Cette réussite a validé des décennies de recherche fondamentale et ouvert la voie à une nouvelle ère de la vaccinologie.
Il est essentiel de comprendre la différence fondamentale entre les nanoparticules lipidiques actuellement utilisées dans les vaccins autorisés et l’oxyde de graphène qui fait l’objet de recherches prospectives. Les LNP des vaccins COVID-19 sont composées de quatre types de lipides soigneusement sélectionnés : un lipide ionisable pour l’encapsulation de l’ARNm, un phospholipide pour la stabilité structurelle, du cholestérol pour la fluidité membranaire, et un lipide PEGylé pour la stabilité colloïdale et la furtivité immunologique. Aucun matériau carboné n’entre dans leur composition.
L’oxyde de graphène, en revanche, représente une approche conceptuellement différente qui fait l’objet de recherches fondamentales pour les vaccins de demain. Contrairement aux LNP qui fonctionnent principalement comme des véhicules de transport, l’oxyde de graphène pourrait combiner les fonctions de vectorisation et d’adjuvantation, offrant potentiellement une solution intégrée plus efficace. Cependant, cette technologie en est encore au stade de la recherche préclinique et nécessite des études approfondies avant toute application clinique, soulignant l’importance de distinguer les technologies actuellement approuvées de celles en développement.
5. Institutions de Recherche dans le Monde

Figure 5 : Scientifiques travaillant sur le développement de vaccins dans un laboratoire de recherche biomédicale ultramoderne
États-Unis : Pionniers de l’Innovation Nanotechnologique
Le Massachusetts Institute of Technology (MIT) se positionne comme l’un des leaders mondiaux dans la recherche sur les nanoparticules vaccinales. Leurs équipes de recherche, dirigées par des scientifiques de renommée internationale, ont développé des plateformes révolutionnaires de nanoparticules métallo-organiques (MOF) capable de servir simultanément de véhicule de délivrance et d’adjuvant. Ces innovations, publiées en 2024, démontrent comment une seule nanoparticule peut générer une réponse immunitaire puissante avec des doses d’antigène considérablement réduites.
Stanford University excelle dans le développement de plateformes de nanovaccins personnalisées. Leurs recherches récentes, publiées en août 2024, portent sur des systèmes de nanoparticules auto-assemblables qui peuvent être adaptés en temps réel pour répondre aux variants émergents de pathogènes. Cette approche modulaire représente une avancée majeure vers des vaccins « universels » capables de conférer une protection contre multiples souches d’un même pathogène.
Harvard Medical School, à travers son programme conjoint Harvard-MIT Health Sciences and Technology, concentre ses efforts sur la compréhension fondamentale des interactions entre nanomatériaux et système immunitaire. Leurs études pionnières sur l’immunologie des nanomatériaux éclairent les mécanismes par lesquels différents types de nanoparticules peuvent moduler les réponses immunitaires, fournissant les bases scientifiques pour le développement rationnel de nouveaux adjuvants.
Europe : L’Excellence Collaborative à Grande Échelle
Le Cambridge Graphene Centre de l’Université de Cambridge représente l’épicentre mondial de la recherche sur le graphène et ses applications biomédicales. Depuis sa création, ce centre a publié plus de 200 articles scientifiques sur les applications médicales du graphène et coordonne de nombreux projets de recherche internationaux. Leurs installations de pointe permettent de synthétiser et caractériser des matériaux à base de graphène avec une précision atomique.
Les Instituts Max Planck en Allemagne, particulièrement l’Institut Max Planck pour la Recherche sur les Solides, mènent des recherches fondamentales sur les propriétés physiques des nanomatériaux bidimensionnels. Leurs travaux sur la nanophysique des solides fournissent les bases théoriques nécessaires à la compréhension des mécanismes d’action de l’oxyde de graphène au niveau moléculaire.
L’Initiative Graphene Flagship, lancée par la Commission européenne en 2013 avec un budget dépassant le milliard d’euros, coordonne les efforts de recherche de 126 partenaires académiques et industriels à travers 23 pays. Cette collaboration sans précédent vise à positionner l’Europe comme leader mondial dans les technologies basées sur le graphène, avec des applications spécifiques dans le domaine biomédical qui représentent 15% du budget total du programme.
Japon : Innovation Technologique et Précision
L’Université de Tokyo, à travers son département de nanosciences, a développé des méthodes innovantes de synthèse de nanorubans de graphène avec un contrôle précis de leurs propriétés électroniques et biologiques. Leurs recherches publiées en 2021 démontrent comment la largeur et la chiralité des nanorubans influencent leur interaction avec les cellules immunitaires, ouvrant de nouvelles voies pour l’optimisation des adjuvants à base de graphène.
L’Université d’Osaka s’est spécialisée dans le développement de biocapteurs au graphène pour la détection précoce de pathogènes. Leurs systèmes, capables de détecter des bactéries responsables du cancer de l’estomac à des concentrations extrêmement faibles, illustrent le potentiel du graphène non seulement comme adjuvant vaccinal mais aussi comme outil de diagnostic complémentaire. Ces recherches, initiées en 2019, ont conduit au développement de plateformes microfluidiques intégrant l’oxyde de graphène.
Les centres de recherche japonais collaborent étroitement avec l’industrie pharmaceutique nationale pour accélérer la translation des découvertes fondamentales vers les applications cliniques. Cette approche intégrée recherche-industrie permet un développement plus rapide et plus efficace des technologies nanotechnologiques appliquées à la santé.
Inde : Émergence d’un Pôle Nanotechnologique
L’Indian Institute of Technology (IIT) Bombay s’est imposé comme un centre d’excellence en nanomédecine avec plus de 45 professeurs de 9 départements différents travaillant de concert sur les applications nanotechnologiques. Leur Centre for Research in Nanotechnology & Science (CRNTS) développe des nanoparticules pour la délivrance pulmonaire de vaccins et des formulations à haute absorption pour améliorer la biodisponibilité des agents thérapeutiques.
L’All India Institute of Medical Sciences (AIIMS) collabore étroitement avec les IIT pour la validation clinique des innovations nanotechnologiques. Cette synergie entre excellence technique et expertise médicale positionne l’Inde comme un acteur émergent dans le développement de nanovaccins adaptés aux défis sanitaires spécifiques des pays en développement.
La Mission Nano de l’Inde, lancée par le gouvernement central, coordonne les efforts de recherche nationaux en nanotechnologie avec un budget significatif dédié aux applications biomédicales. Cette initiative stratégique vise à positionner l’Inde comme un leader dans les nanotechnologies abordables et accessibles, particulièrement importante dans le contexte de l’équité vaccinale mondiale.
6. L’Initiative Graphene Flagship en Europe

Figure 6 : Vue d’ensemble des applications biomédicales du graphène développées par le consortium européen Graphene Flagship
L’Initiative Graphene Flagship représente l’un des programmes de recherche les plus ambitieux jamais lancés par l’Union européenne. Officiellement inaugurée en octobre 2013, cette initiative phare bénéficie d’un financement colossal de plus d’un milliard d’euros sur dix ans, reflétant l’engagement stratégique de l’Europe à maintenir son leadership dans les technologies révolutionnaires basées sur les matériaux bidimensionnels. Cette vision à long terme témoigne de la reconnaissance par les décideurs européens du potentiel transformateur du graphène et de ses dérivés pour l’industrie du futur.
Les objectifs de cette initiative dépassent largement le cadre de la recherche fondamentale pour englober une approche holistique de l’innovation technologique. Le programme vise à créer un écosystème européen intégré combinant recherche de pointe, développement technologique, formation de personnel hautement qualifié, et transfert vers l’industrie. Dans le domaine biomédical spécifiquement, l’initiative alloue environ 150 millions d’euros sur sa durée totale, reconnaissant le potentiel révolutionnaire du graphène pour transformer la médecine moderne.
Les applications biomédicales développées dans le cadre du Graphene Flagship couvrent un spectre impressionnant d’innovations. Les dispositifs médicaux implantables à base de graphène promettent une biocompatibilité supérieure et des fonctionnalités avancées pour le monitoring physiologique en temps réel. Les systèmes de délivrance de médicaments exploitent les propriétés uniques du graphène pour un ciblage cellulaire précis et une libération contrôlée des substances actives. Les biocapteurs ultra-sensibles permettent une détection précoce de biomarqueurs de maladies à des concentrations jusqu’alors indétectables.
Parmi les projets phares actuellement en développement, le projet 2D-BioPAD vise à créer des pansements intelligents incorporant des nanomatériaux bidimensionnels capables de surveiller la cicatrisation et de délivrer des agents thérapeutiques de manière adaptative. Le projet MUNASET développe des nanosystèmes multifonctionnels pour le traitement du cancer, combinant imagerie, thérapie ciblée et monitoring thérapeutique. Le projet GRAPHERGIA explore l’utilisation du graphène dans la médecine régénérative, particulièrement pour la réparation du système nerveux.
Les innovations pour dispositifs médicaux développées par le consortium européen incluent des interfaces neurales flexibles capables d’enregistrer et de stimuler l’activité cérébrale avec une résolution spatiale et temporelle sans précédent. Ces dispositifs, testés dans le cadre d’études précliniques pour le traitement de l’épilepsie et de la maladie de Parkinson, illustrent le potentiel du graphène à révolutionner les neurotechnologies. Parallèlement, des biocapteurs portables basés sur le graphène promettent de transformer le diagnostic médical en permettant des analyses biologiques complexes en temps réel, directement au point de soins.
L’impact scientifique de l’Initiative Graphene Flagship se mesure non seulement par le nombre impressionnant de publications scientifiques générées – plus de 3000 articles dans des revues à comité de lecture – mais aussi par la qualité des innovations développées. Le programme a déjà donné naissance à plus de 70 start-ups spécialisées dans les technologies du graphène, créant un écosystème entrepreneurial dynamique. Cette approche intégrée recherche-innovation-entrepreneuriat constitue un modèle pour les futures initiatives scientifiques européennes de grande envergure.
7. Interactions Nanomatériaux-Système Immunitaire
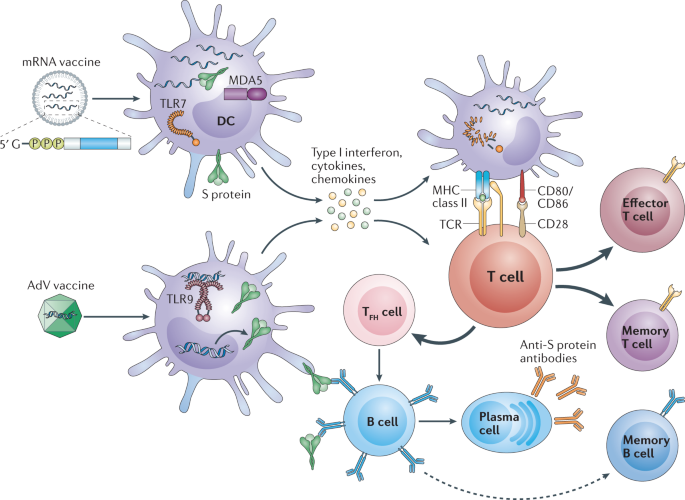
Figure 7 : Mécanismes complexes d’interaction entre les nanomatériaux et les différentes composantes du système immunitaire
La reconnaissance des nanoparticules par le système immunitaire constitue un processus d’une complexité fascinante qui détermine largement le succès ou l’échec des applications nanotechnologiques en médecine. Cette reconnaissance implique une cascade d’événements moléculaires et cellulaires sophistiqués, débutant par l’interaction initiale entre les nanomatériaux et les protéines plasmatiques qui forment instantanément une « couronne protéique » autour des nanoparticules. Cette couronne, composée principalement d’albumine, d’immunoglobulines et de protéines du complément, constitue l’identité biologique réelle que « voit » le système immunitaire.
Les cellules dendritiques, véritables sentinelles du système immunitaire, jouent un rôle central dans la reconnaissance et le traitement des nanomatériaux. Ces cellules présentatrices d’antigènes professionnelles possèdent une capacité remarquable à capturer, traiter et présenter les antigènes aux lymphocytes T naïfs, orchestrant ainsi l’initiation de la réponse immunitaire adaptative. Lorsqu’elles rencontrent des nanoparticules, les cellules dendritiques activent plusieurs mécanismes de reconnaissance incluant l’endocytose médiée par les récepteurs, la phagocytose et la macropinocytose.
La présentation des antigènes représente l’étape cruciale où l’information antigénique est « traduite » en signal reconnaissable par les lymphocytes T. Ce processus implique la dégradation des antigènes internalisés en peptides courts, leur chargement sur les molécules du complexe majeur d’histocompatibilité (CMH) de classe I ou II, et leur présentation à la surface cellulaire. Les nanomatériaux peuvent influencer cette présentation de multiples façons : en protégeant les antigènes de la dégradation, en facilitant leur transport vers les compartiments cellulaires appropriés, ou en modulant l’expression des molécules de CMH.
L’activation des lymphocytes T constitue l’étape décisive de l’initiation de l’immunité adaptative spécifique. Cette activation nécessite deux signaux distincts : le premier, fourni par l’interaction entre le récepteur des cellules T (TCR) et le complexe peptide-CMH, confère la spécificité antigénique ; le second, délivré par les molécules de costimulation exprimées par les cellules dendritiques activées, détermine la nature et l’intensité de la réponse. Les nanomatériaux peuvent influencer cette activation en modulant l’expression des molécules de costimulation et en favorisant la formation de synapses immunologiques stables.
La production de cytokines représente le langage moléculaire par lequel les cellules immunitaires communiquent et coordonnent leur réponse. L’exposition aux nanomatériaux déclenche la sécrétion d’un profil spécifique de cytokines qui oriente la différenciation des lymphocytes T vers différents sous-types effecteurs. Les cytokines pro-inflammatoires comme l’IL-1β, l’IL-6 et le TNF-α favorisent une réponse Th1 caractérisée par l’activation des lymphocytes T cytotoxiques et des macrophages, essentielle pour l’immunité contre les pathogènes intracellulaires. D’autres cytokines comme l’IL-4 et l’IL-5 orientent vers une réponse Th2 caractérisée par la production d’anticorps, cruciale pour la neutralisation des pathogènes extracellulaires.
La réponse immunitaire adaptative résultante se caractérise par la génération de lymphocytes T et B mémoires, véritables gardiens de l’immunité à long terme. Ces cellules mémoires, dotées d’une longévité exceptionnelle et d’une capacité de réactivation rapide, constituent la base de la protection vaccinale durable. Les nanomatériaux peuvent influencer la génération et le maintien de ces cellules mémoires en créant des dépôts antigéniques à libération prolongée, en modulant les voies de signalisation impliquées dans la différenciation des cellules mémoires, et en favorisant l’établissement de niches anatomiques propices à leur survie à long terme.
8. Applications Futures et Essais Cliniques

Figure 8 : Plateformes innovantes de nanovaccins pour applications thérapeutiques et préventives de nouvelle génération
Les vaccins contre le cancer représentent l’une des applications les plus prometteuses de la nanotechnologie vaccinale. Cette approche révolutionnaire vise à reprogrammer le système immunitaire pour qu’il reconnaisse et élimine spécifiquement les cellules cancéreuses, transformant ainsi le paradigme thérapeutique oncologique. Les nanovaccins anticancéreux actuellement en développement exploitent les antigènes associés aux tumeurs (TAA) ou les néo-antigènes spécifiques de chaque patient, encapsulés dans des systèmes de délivrance nanotechnologiques sophistiqués pour assurer un ciblage précis des cellules dendritiques.
Le développement de vaccins universels contre la grippe constitue un défi scientifique majeur que la nanotechnologie pourrait résoudre de manière élégante. Contrairement aux vaccins grippaux actuels qui doivent être reformulés annuellement pour correspondre aux souches circulantes, un vaccin universel viserait les régions conservées du virus, notamment la tige de l’hémagglutinine, pour conférer une protection durable contre toutes les souches grippales. Les nanoparticules permettraient de présenter ces antigènes conservés de manière optimale au système immunitaire, surpassant les limitations des approches vaccinales conventionnelles.
Les plateformes de vaccination personnalisées représentent l’avenir de la médecine de précision appliquée à la prévention. Ces systèmes adaptatifs utilisent les données génomiques, protéomiques et immunologiques individuelles pour concevoir des formulations vaccinales sur mesure, optimisées pour chaque profil immunologique spécifique. Les nanotechnologies modulaires permettraient d’assembler rapidement des composants vaccinaux standardisés en formulations personnalisées, révolutionnant ainsi l’approche « one-size-fits-all » traditionnelle de la vaccination.
Les essais précliniques actuels explorent de multiples approches nanotechnologiques innovantes. Les nanoparticules auto-assemblables programmables peuvent s’organiser spontanément en structures complexes mimant les pathogènes naturels, déclenchant des réponses immunitaires puissantes sans les risques associés aux agents infectieux. Les systèmes de délivrance à libération contrôlée permettent d’administrer les antigènes selon des profils temporels optimisés, reproduisant les cinétiques d’exposition naturelles lors d’infections réelles. Les nanocarriers ciblés utilisent des ligands spécifiques pour délivrer sélectivement les antigènes aux sous-populations cellulaires appropriées.
Malgré ces avancées prometteuses, plusieurs défis majeurs doivent être surmontés avant la translation clinique. La standardisation des procédés de synthèse des nanomatériaux reste complexe, nécessitant des contrôles qualité rigoureux pour assurer la reproductibilité batch-à-batch. L’évaluation de la sécurité à long terme des nanomatériaux nécessite des études de biodistribution, de bioaccumulation et d’élimination approfondies. La scalabilité industrielle des procédés de fabrication doit être démontrée pour permettre une production de masse économiquement viable.
La timeline de développement prévue s’étend sur la prochaine décennie, avec les premiers essais cliniques de phase I attendus d’ici 2026-2027 pour les candidats les plus avancés. L’approbation réglementaire des premiers nanovaccins commerciaux pourrait intervenir vers 2030-2035, sous réserve de résultats cliniques favorables et d’un profil de sécurité acceptable. Cette chronologie reflète la complexité inhérente au développement de technologies révolutionnaires tout en soulignant l’urgence de progresser face aux défis sanitaires émergents qui nécessitent des solutions vaccinales innovantes.
9. Considérations de Sécurité et Surveillance Réglementaire
La supervision réglementaire des innovations nanotechnologiques vaccinales implique une coordination internationale sans précédent entre les principales agences sanitaires mondiales. Cette harmonisation des standards réglementaires reflète la reconnaissance partagée que les nanotechnologies représentent un paradigme nouveau nécessitant des approches évaluatives adaptées, dépassant les cadres réglementaires traditionnels conçus pour les médicaments conventionnels.
Organismes de Réglementation Internationaux
La Food and Drug Administration (FDA) des États-Unis a établi des guidelines spécifiques pour l’évaluation des produits nanotechnologiques, incluant des protocoles d’évaluation de la caractérisation physico-chimique, de la biocompatibilité et de la biodistribution. L’agence a créé un centre d’excellence en nanotechnologie pour coordonner l’expertise réglementaire et scientifique nécessaire à l’évaluation de ces technologies émergentes.
L’Agence européenne des médicaments (EMA) développe un cadre réglementaire harmonisé pour les nanomedicaments à travers son comité des médicaments à usage humain (CHMP). Les guidelines européennes mettent l’accent sur l’évaluation des risques spécifiques aux nanomatériaux, incluant leur potentiel d’accumulation tissulaire et leurs interactions avec les barrières biologiques naturelles.
L’Agence pharmaceutique et dispositifs médicaux du Japon (PMDA) collabore étroitement avec ses homologues internationaux pour développer des standards d’évaluation adaptés aux spécificités des nanomatériaux. L’approche japonaise privilégie une évaluation case-by-case tenant compte des propriétés uniques de chaque nanomatériau.
L’Organisation centrale de contrôle des médicaments standard de l’Inde (CDSCO) adapte progressivement ses procédures d’approbation pour intégrer les spécificités des nanotechnologies, reconnaissant l’importance stratégique de ces innovations pour répondre aux besoins sanitaires de sa population massive.
Protocoles de Sécurité Rigoureux
Les études de toxicité pour les nanomatériaux vaccinaux suivent des protocoles spécialisés tenant compte de leurs propriétés physico-chimiques uniques. Ces évaluations incluent des tests de cytotoxicité in vitro sur multiples lignées cellulaires, des études de génotoxicité pour évaluer le potentiel mutagène, et des analyses d’immunotoxicité pour détecter d’éventuelles réactions immunitaires aberrantes. Les protocoles intègrent également des évaluations spécifiques aux nanomatériaux comme l’analyse de la génération d’espèces réactives de l’oxygène et l’évaluation des interactions avec les protéines plasmatiques.
L’évaluation de la biodistribution et de l’élimination constitue un aspect critique spécifique aux nanomatériaux. Ces études utilisent des techniques de traçage sophistiquées, incluant la microscopie électronique, la spectrométrie de masse et l’imagerie par fluorescence, pour suivre le devenir des nanoparticules dans l’organisme. Les paramètres évalués incluent la cinétique de distribution tissulaire, les voies d’élimination, la demi-vie biologique et le potentiel de bioaccumulation à long terme.
La surveillance post-commercialisation des nanovaccins nécessite des systèmes de pharmacovigilance adaptés capables de détecter des effets indésirables potentiellement spécifiques aux nanomatériaux. Ces systèmes intègrent des biomarqueurs d’exposition aux nanomatériaux et des protocoles de surveillance à long terme pour détecter d’éventuels effets retardés. La traçabilité des lots de fabrication est renforcée pour permettre une investigation rapide en cas de signal de sécurité.
La transparence des ingrédients représente un pilier fondamental de l’acceptabilité publique des nanovaccins. Les autorités réglementaires exigent une divulgation complète de la composition, incluant la caractérisation détaillée des nanomatériaux utilisés, leurs méthodes de synthèse, et leurs spécifications de qualité. Cette transparence s’étend aux processus de fabrication, aux contrôles qualité et aux données de sécurité précliniques et cliniques.
Les standards de qualité pour les nanomatériaux vaccinaux incluent des spécifications strictes sur la taille, la forme, la surface spécifique, la pureté chimique et la stabilité. Les méthodes analytiques utilisées pour ces caractérisations doivent être validées selon les standards internationaux et régulièrement mises à jour pour refléter les avancées technologiques. L’harmonisation internationale de ces standards facilite le développement global et l’accès équitable aux innovations nanotechnologiques vaccinales.
10. Conclusion : L’Avenir de la Nanotechnologie Vaccinale
La convergence entre nanotechnologie et vaccinologie inaugure une ère révolutionnaire dans la prévention et le traitement des maladies infectieuses et du cancer. Les recherches approfondies menées dans les institutions de pointe mondiale démontrent de manière convaincante que l’oxyde de graphène et d’autres nanomatériaux innovants possèdent un potentiel transformateur pour surmonter les limitations des approches vaccinales conventionnelles. Cette révolution nanotechnologique promet de créer des vaccins plus efficaces, plus sûrs et mieux adaptés aux défis sanitaires contemporains et futurs.
Le potentiel révolutionnaire de ces technologies se manifeste à travers leur capacité unique à intégrer multiples fonctionnalités au sein d’une plateforme unifiée : protection et vectorisation des antigènes, stimulation ciblée du système immunitaire, délivrance contrôlée dans le temps et l’espace, et personnalisation selon les profils individuels. Cette approche multifonctionnelle représente un saut qualitatif par rapport aux vaccins actuels, ouvrant la voie à des solutions thérapeutiques intégrées qui dépassent la simple prévention pour englober le traitement de maladies établies.
La collaboration internationale exemplaire illustrée par l’Initiative Graphene Flagship européenne, les programmes de recherche américains, les innovations technologiques japonaises et l’émergence de l’expertise indienne démontre que l’innovation nanotechnologique vaccinale bénéficie d’un momentum scientifique global. Cette synergie internationale accélère considérablement le rythme de découverte et facilite le partage d’expertise, de ressources et de meilleures pratiques, essentiels pour relever les défis complexes du développement nanotechnologique.
Les innovations attendues d’ici 2030-2035 incluent des vaccins universels contre la grippe capables de conférer une protection durable indépendamment des mutations virales, des nanovaccins anticancéreux personnalisés basés sur le profil génétique tumoral individuel, et des plateformes vaccinales adaptatifs pouvant être rapidement reconfigurées en réponse à l’émergence de nouveaux pathogènes. Ces avancées promettent de transformer fondamentalement notre capacité à anticiper, prévenir et traiter les menaces sanitaires émergentes.
L’importance de la recherche éthique et responsable ne peut être sous-estimée dans ce contexte révolutionnaire. Le développement de nanotechnologies vaccinales doit s’accompagner d’une évaluation rigoureuse des implications sociétales, incluant l’équité d’accès, la justice distributive globale et le respect des principes de précaution. La transparence scientifique, l’engagement public et la participation des parties prenantes constituent les fondements essentiels pour assurer une acceptabilité sociale et une adoption réussie de ces innovations transformatrices.
La vision pour l’avenir de la médecine intégrant les nanotechnologies vaccinales s’articule autour d’une médecine préventive personnalisée, prédictive et participative. Cette médecine du futur utilisera les données individuelles génomiques, immunologiques et environnementales pour concevoir des interventions préventives sur mesure, optimisant la protection sanitaire de chaque individu tout en contribuant à l’immunité collective. L’intégration harmonieuse de l’intelligence artificielle, de la nanotechnologie et de la médecine de précision créera un écosystème sanitaire intelligent, réactif et adaptatif, capable de s’ajuster continuellement aux défis sanitaires évolutifs de notre monde interconnecté.
