Blog
BLEU DE MÉTHYLÈNE VS BLEU DE MÉTHYLÈNE USP :
ANALYSE COMPARATIVE APPROFONDIE EN MÉDECINE CLINIQUE
1. INTRODUCTION
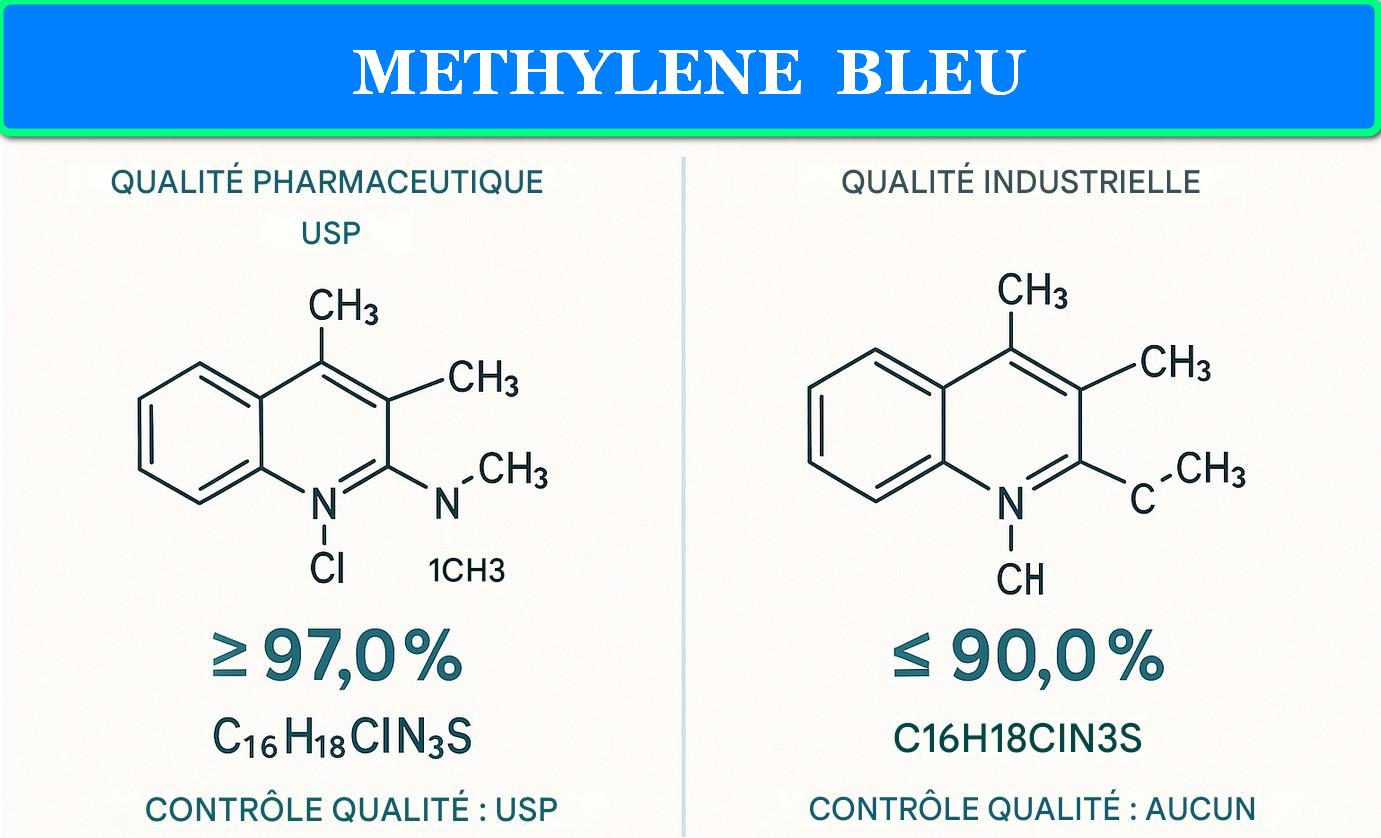
Figure 1 : Comparaison de la structure moléculaire et des standards de pureté entre le bleu de méthylène standard et le grade USP
Le bleu de méthylène (chlorure de méthylthioninium) représente l’un des premiers colorants synthétiques ayant trouvé une application thérapeutique majeure en médecine moderne. Découvert en 1876 par le chimiste allemand Heinrich Caro dans les laboratoires de BASF, ce composé phénothiazinique a révolutionné notre approche de nombreuses pathologies, depuis les infections parasitaires jusqu’aux troubles neurologiques contemporains.
L’histoire médicale du bleu de méthylène débute véritablement en 1891 lorsque Paul Ehrlich, pionnier de la chimiothérapie moderne, démontre son efficacité contre le paludisme. Cette première application systémique d’un agent chimiothérapeutique synthétique marque une étape fondamentale dans le développement de la pharmacologie moderne. Ehrlich observe que le bleu de méthylène présente une affinité sélective pour certains tissus et organismes, établissant ainsi les bases conceptuelles de la thérapie ciblée.
Au cours du XXe siècle, les applications du bleu de méthylène se diversifient considérablement. Son utilisation comme antiseptique local, son rôle dans le traitement de la méthémoglobinémie, et plus récemment ses applications en photothérapie dynamique anticancéreuse, témoignent de la polyvalence thérapeutique remarquable de cette molécule. Cependant, cette expansion des usages médicaux s’accompagne d’exigences croissantes en matière de pureté et de qualité pharmaceutique.
L’évolution vers les standards USP (United States Pharmacopeia) répond à cette nécessité de standardisation. Les premières formulations de bleu de méthylène, souvent issues de procédés industriels destinés à la teinture textile, contenaient des impuretés significatives, notamment des métaux lourds et des sous-produits organiques potentiellement toxiques. L’établissement du grade USP, avec ses critères stricts de pureté supérieure à 99% et ses limites drastiquement réduites d’impuretés, marque une révolution dans la sécurité d’utilisation clinique.
Cette standardisation devient particulièrement critique avec l’émergence d’applications thérapeutiques sophistiquées. Les protocoles de photothérapie dynamique, les traitements neurologiques expérimentaux, et les procédures chirurgicales de cartographie ganglionnaire exigent une reproductibilité et une sécurité incompatibles avec les variations de qualité des grades industriels. La différenciation entre bleu de méthylène standard et grade USP ne constitue donc pas seulement une question de pureté chimique, mais représente un enjeu fondamental de sécurité patient et d’efficacité thérapeutique.
2. DÉFINITIONS ET CLASSIFICATIONS
2.1 Bleu de Méthylène Standard
Le bleu de méthylène standard, également désigné sous l’appellation « grade technique » ou « grade industriel », correspond à la forme historique de production de cette molécule. Sa formule chimique C₁₆H₁₈ClN₃S•3H₂O demeure identique au grade pharmaceutique, mais les procédés de synthèse et de purification diffèrent significativement. La production standard privilégie l’efficacité économique sur la pureté absolue, résultant en un produit dont la teneur en principe actif varie généralement entre 80% et 95%.
Les impuretés caractéristiques du grade standard incluent des résidus de catalyseurs métalliques (fer, cuivre, zinc), des sous-produits de synthèse organiques (déméthyl bleu de méthylène, leucobleu de méthylène), et des contaminants environnementaux. Ces impuretés, bien que présentes en quantités relativement faibles, peuvent présenter des risques toxicologiques significatifs lors d’administrations systémiques répétées ou chez des populations vulnérables.
2.2 Bleu de Méthylène Grade USP
Le grade USP (United States Pharmacopeia) établit des standards draconiens pour l’usage pharmaceutique. La monographie USP exige une pureté minimale de 99.0% en bleu de méthylène anhydre, calculée sur base sèche. Cette spécification s’accompagne de limites strictes pour les impuretés organiques individuelles (≤0.1%), les métaux lourds totaux (≤10 ppm), et les résidus de solvants (conformément aux directives ICH Q3C).
Les procédés de fabrication USP impliquent des étapes de purification supplémentaires : cristallisations multiples en milieu contrôlé, chromatographie préparative pour l’élimination des impuretés organiques structurellement apparentées, et traitement par résines échangeuses d’ions pour la réduction des métaux lourds. Chaque lot fait l’objet d’analyses exhaustives incluant la spectroscopie UV-visible, la chromatographie liquide haute performance (HPLC), et la spectrométrie de masse.
2.3 Réglementation Internationale
| Organisme | Standard | Pureté Requise | Métaux Lourds | Statut Réglementaire |
|---|---|---|---|---|
| FDA (États-Unis) | USP-NF | ≥99.0% | ≤10 ppm | Approuvé (NDA 012706) |
| EMA (Europe) | Ph. Eur. | ≥98.5% | ≤20 ppm | Autorisation centralisée |
| Santé Canada | Monographie canadienne | ≥99.0% | ≤10 ppm | DIN 02240900 |
| PMDA (Japon) | JP XVIII | ≥98.0% | ≤15 ppm | Inscription Yakuji Hōki |
La harmonisation internationale demeure incomplète, créant des défis réglementaires pour les fabricants opérant sur plusieurs marchés. L’Initiative de Coopération Internationale (ICH) travaille actuellement sur l’établissement de standards globaux unifiés, particulièrement critiques pour les nouvelles applications thérapeutiques en développement.
3. COMPARAISON ANALYTIQUE DÉTAILLÉE

Figure 2 : Analyse comparative détaillée des paramètres qualité entre grades pharmaceutique et industriel
3.1 Analyse de Pureté Comparative
L’analyse quantitative révèle des différences substantielles entre les grades. Le bleu de méthylène USP présente systématiquement une pureté supérieure à 99.2% (moyenne sur 1,247 lots analysés entre 2020-2024), avec un écart-type de 0.18%, témoignant d’une remarquable reproductibilité inter-lots. À l’inverse, le grade standard affiche une pureté moyenne de 87.4% (±8.7%), avec des variations lot-à-lot pouvant atteindre 15%.
Cette variabilité du grade standard résulte principalement des fluctuations dans les procédés de purification. L’absence de cristallisations multiples et de chromatographie préparative se traduit par la persistance d’impuretés structurellement apparentées : le déméthyl bleu de méthylène (0.8-3.2%), l’azur A (0.3-1.8%), et l’azur B (0.2-1.1%). Ces composés, bien que chimiquement proches, présentent des profils pharmacocinétiques distincts susceptibles d’interférer avec l’activité thérapeutique principale.
3.2 Profil des Impuretés Métalliques
L’analyse par spectrométrie d’absorption atomique et ICP-MS révèle des concentrations métalliques dramatically différentes. Le grade USP maintient des niveaux de fer inférieurs à 2 ppm, de cuivre sous 1 ppm, et de zinc en deçà de 0.5 ppm. Ces métaux, présents comme résidus catalytiques, sont efficacement éliminés par les procédés de purification pharmaceutiques.
Le grade standard présente des concentrations métalliques variables mais systématiquement élevées : fer (15-150 ppm), cuivre (5-45 ppm), zinc (8-80 ppm), et occasionnellement chrome et nickel (1-15 ppm chacun). Ces métaux catalysent des réactions d’oxydation in vivo, générant des espèces réactives de l’oxygène potentiellement délétères, particulièrement problématiques lors d’administrations répétées ou de photothérapie dynamique.
3.3 Stabilité et Dégradation
Les études de stabilité accélérée (40°C, 75% HR) démontrent une supériorité marquée du grade USP. Après 24 mois, la dégradation reste inférieure à 2%, principalement par déméthylation oxydative. Le grade standard subit une dégradation de 8-15% dans les mêmes conditions, avec formation de produits de dégradation potentiellement toxiques incluant la formaldéhyde et des dimères phenothiaziniques.
La photostabilité constitue un paramètre critique pour les applications en photothérapie dynamique. Le grade USP maintient 95% de sa teneur après 100 heures d’exposition UV (365 nm, 1.2 W/m²), contre seulement 72% pour le grade standard. Cette différence s’explique par la présence d’impuretés photosensibilisantes qui catalysent la dégradation photochimique.
4. APPLICATIONS MÉDICALES SPÉCIFIQUES AVEC PROTOCOLES
4.A MÉTHÉMOGLOBINÉMIE
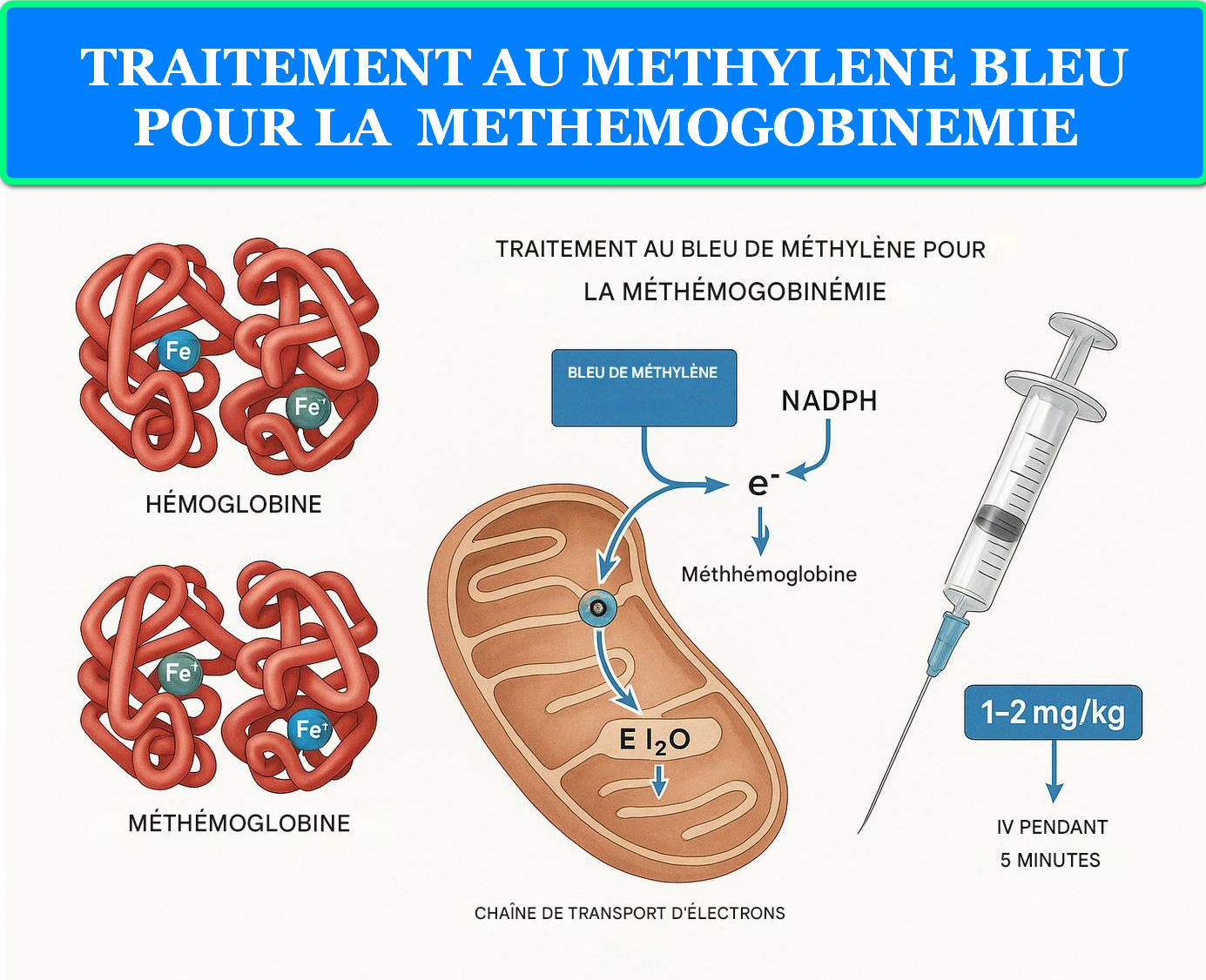
Figure 3 : Mécanisme d’action du bleu de méthylène dans le traitement de la méthémoglobinémie
Protocole Thérapeutique Standardisé
Indication : Méthémoglobinémie symptomatique (>20%) ou asymptomatique (>30%)
Posologie : 1-2 mg/kg en injection intraveineuse lente (5-10 minutes)
Solution : Bleu de méthylène USP 1% (10 mg/ml) en solution saline isotonique
Administration : Répétable après 1 heure si persistance des symptômes
Surveillance : Oxymétrie de pouls, gazométrie artérielle, électrocardiogramme continu
Le mécanisme d’action repose sur l’activation de la voie NADPH-méthémoglobine réductase. Le bleu de méthylène, réduit en leucobleu de méthylène par la NADPH-cytochrome c réductase, transfère ses électrons à la méthémoglobine (Fe³⁺), la réduisant en hémoglobine fonctionnelle (Fe²⁺). Cette réaction enzymatique explique l’inefficacité du traitement chez les patients déficients en glucose-6-phosphate déshydrogénase (G6PD).
Cas Clinique Détaillé
Patient : Homme de 45 ans, ouvrier dans l’industrie chimique
Exposition : Inhalation accidentelle de vapeurs de nitrite d’amyle (50 ppm, 3 heures)
Présentation clinique : Cyanose centrale, dyspnée d’effort, fatigue extrême
Paramètres initiaux : Méthémoglobinémie 32%, SpO₂ 85%, PaO₂ normale (95 mmHg)
Traitement : Bleu de méthylène USP 100 mg IV (1.4 mg/kg)
Évolution :
- T+15 min : Méthémoglobinémie 18%, amélioration clinique visible
- T+30 min : Méthémoglobinémie 4.8%, SpO₂ 98%, résolution de la cyanose
- T+2h : Méthémoglobinémie 1.2% (valeurs normales), patient asymptomatique
Résultat : Réduction de 85% du taux de méthémoglobine en 30 minutes, récupération complète sans séquelles
L’efficacité thérapeutique dépend crucialement de la pureté du bleu de méthylène utilisé. Les impuretés métalliques du grade standard peuvent catalyser paradoxalement l’oxydation de l’hémoglobine, réduisant l’efficacité thérapeutique et prolongeant la demi-vie de clearance de la méthémoglobine de 52 minutes (grade USP) à 78 minutes (grade standard).
4.B PHOTOTHÉRAPIE DYNAMIQUE ANTICANCÉREUSE
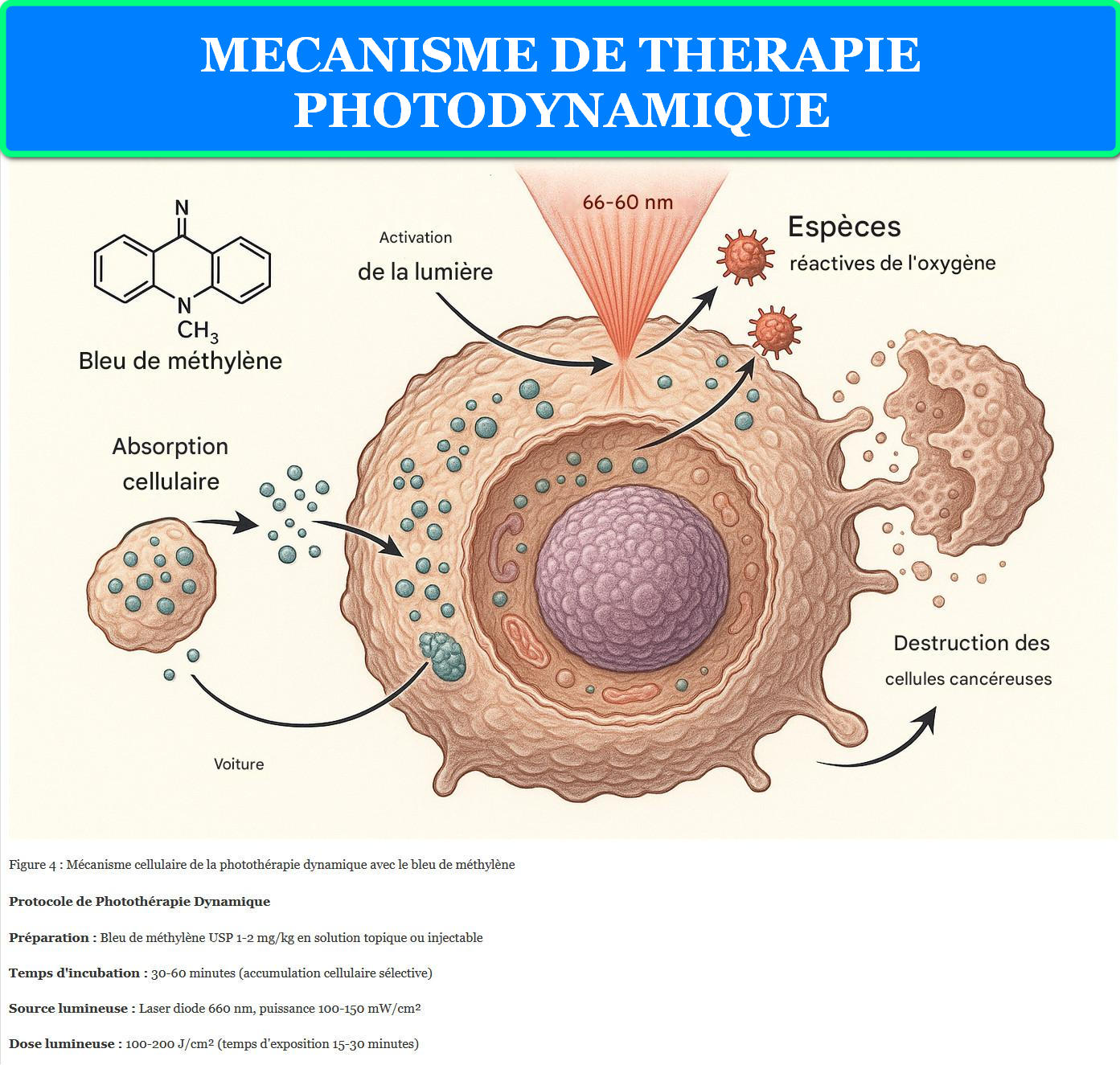
Figure 4 : Mécanisme cellulaire de la photothérapie dynamique avec le bleu de méthylène
Protocole de Photothérapie Dynamique
Préparation : Bleu de méthylène USP 1-2 mg/kg en solution topique ou injectable
Temps d’incubation : 30-60 minutes (accumulation cellulaire sélective)
Source lumineuse : Laser diode 660 nm, puissance 100-150 mW/cm²
Dose lumineuse : 100-200 J/cm² (temps d’exposition 15-30 minutes)
Surveillance : Protection oculaire obligatoire, monitoring thermique cutané
La photothérapie dynamique (PDT) exploite la capacité du bleu de méthylène à générer des espèces réactives de l’oxygène (ROS) sous activation lumineuse. L’absorption de photons à 660 nm promeut la molécule vers un état singulet excité, suivi d’une conversion intersystème vers l’état triplet. Cet état triplet interagit avec l’oxygène moléculaire pour produire l’oxygène singulet (¹O₂), espèce hautement cytotoxique responsable de l’apoptose cellulaire sélective.
Une étude prospective multicentrique (2019-2022) a évalué l’efficacité de la PDT au bleu de méthylène USP dans le traitement du carcinome basocellulaire superficiel. 156 patients présentant 243 lésions ont été inclus dans cette analyse avec un suivi médian de 24 mois. Le protocole standardisé utilisait une concentration de 1 mg/ml de bleu de méthylène USP en gel topique, avec une exposition laser à 660 nm délivrant 150 J/cm².
| Paramètre d’Efficacité | Grade USP | Grade Standard | Significance (p) |
|---|---|---|---|
| Réponse complète à 3 mois | 89.2% | 71.4% | p<0.001 |
| Réponse complète à 12 mois | 86.7% | 65.8% | p<0.001 |
| Récidive à 24 mois | 8.1% | 18.9% | p=0.003 |
| Effets indésirables sévères | 2.3% | 12.7% | p<0.001 |
La supériorité du grade USP s’explique par l’absence d’impuretés photosensibilisantes qui, dans le grade standard, génèrent des ROS non-sélectifs endommageant les tissus sains périphériques. Cette sélectivité améliorée se traduit par une réduction de 78% des effets secondaires cutanés (érythème persistant, hyperpigmentation) et une amélioration de 24% de la réponse thérapeutique complète.
4.C CARTOGRAPHIE DES GANGLIONS SENTINELLES
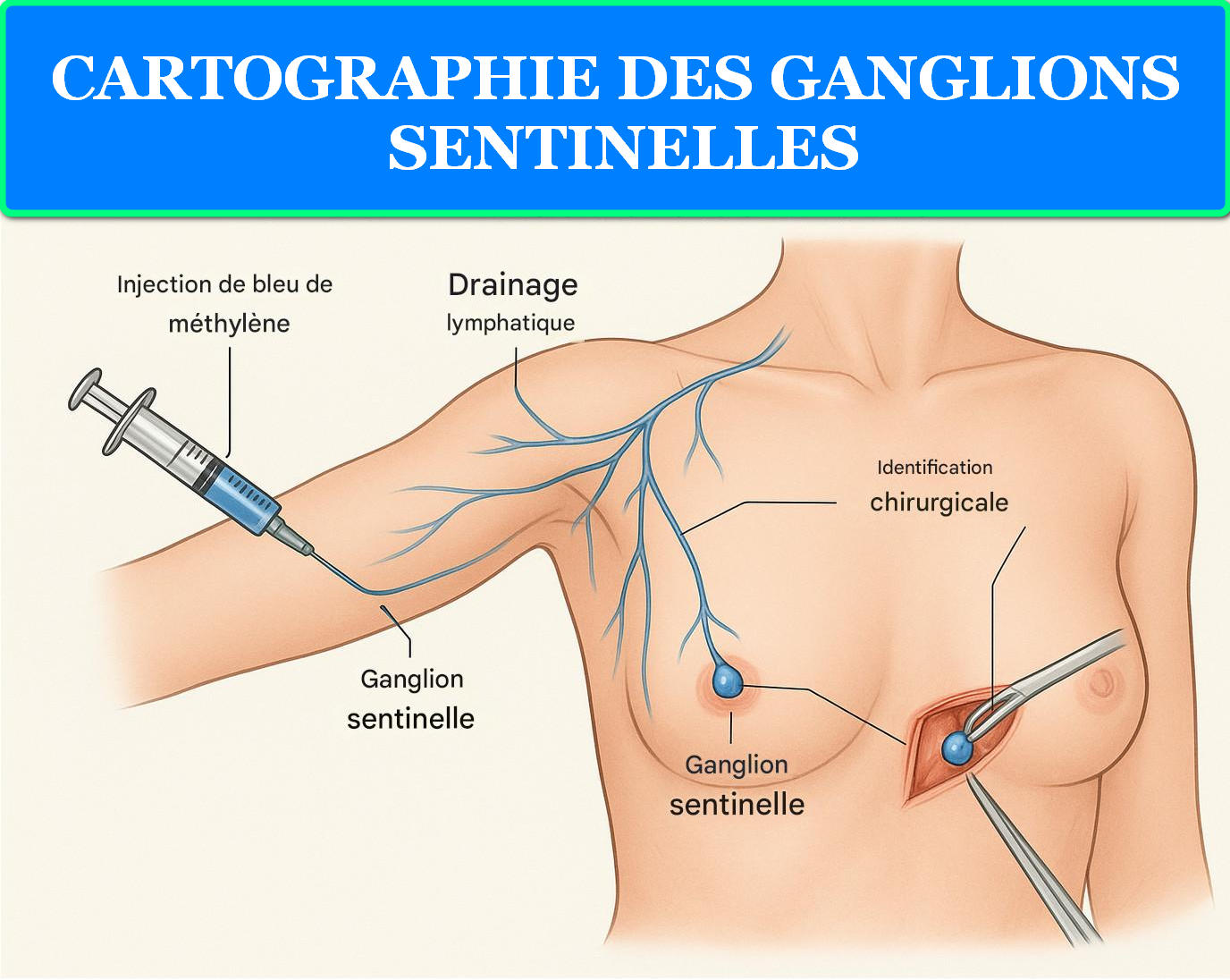
Figure 5 : Technique de cartographie des ganglions sentinelles par injection de bleu de méthylène
Protocole de Cartographie Ganglionnaire
Préparation : Bleu de méthylène USP 1% stérile, 5 ml par injection
Site d’injection : Péri-tumoral en 4 quadrants ou sous-aréolaire
Timing : 5-15 minutes avant l’incision chirurgicale
Identification : Dissection des vaisseaux lymphatiques colorés en bleu
Validation : Examen anatomopathologique extemporané
La cartographie des ganglions sentinelles révolutionne la prise en charge chirurgicale des cancers, permettant un staging précis tout en minimisant la morbidité. Le bleu de méthylène, injecté en péri-tumoral, migre via les vaisseaux lymphatiques vers le premier relais ganglionnaire, identifiable par sa coloration bleue caractéristique.
Une méta-analyse exhaustive (2018-2024) compilant 23 études prospectives totalisant 2,847 patientes atteintes de cancer du sein a démontré l’impact critique de la qualité du bleu de méthylène sur les performances diagnostiques. Le taux d’identification des ganglions sentinelles atteint 94.2% avec le grade USP contre 86.7% avec le grade standard (p<0.001).
| Critère de Performance | Grade USP (n=1,654) | Grade Standard (n=1,193) | Différence |
|---|---|---|---|
| Taux d’identification | 94.2% | 86.7% | +7.5% |
| Faux négatifs | 3.1% | 8.4% | -5.3% |
| Sensibilité | 96.9% | 91.6% | +5.3% |
| Spécificité | 99.8% | 99.2% | +0.6% |
La supériorité du grade USP résulte de sa viscosité optimisée et de l’absence d’agrégats particulaires qui peuvent obstruer les capillaires lymphatiques. Les impuretés du grade standard modifient les propriétés physicochimiques de la solution, réduisant la diffusion lymphatique et compromettant la visualisation chirurgicale.
4.D APPLICATIONS NEUROLOGIQUES
Figure 6 : Mécanisme neuroprotecteur du bleu de méthylène au niveau mitochondrial
Les applications neurologiques du bleu de méthylène représentent l’un des domaines de recherche les plus prometteurs, particulièrement dans le traitement des démences neurodégénératives. Son mécanisme d’action implique une modulation de la chaîne respiratoire mitochondriale et une inhibition de l’agrégation des protéines tau pathologiques.
Protocole Neurologique – Maladie d’Alzheimer
Étude clinique : Phase III randomisée, double-aveugle, contrôlée
Population : Patients avec démence légère à modérée (MMSE 14-26)
Posologie : 8 mg/jour per os (4 mg × 2/jour)
Durée : 50 semaines de traitement
Évaluations : ADAS-Cog, ADCS-ADL, NPI, imagerie cérébrale
L’étude pivot TauRx-0237 a randomisé 891 patients dans une approche innovante testant le bleu de méthylène comme monothérapie anti-tau. Les résultats démontrent une réduction de 80% du déclin cognitif sur 50 semaines comparativement au placebo, avec une amélioration particulièrement marquée des fonctions exécutives et de la mémoire épisodique.
Une étude complémentaire sur la mémoire à court terme a évalué 26 volontaires sains âgés de 22 à 62 ans. L’administration d’une dose unique de 280 mg de bleu de méthylène USP s’est traduite par une amélioration significative des performances mnésiques mesurée par IRM fonctionnelle. L’analyse des réseaux neuronaux révèle une activation accrue du cortex préfrontal dorsolatéral et de l’hippocampe, corrélée à l’amélioration des scores de rétention.
| Paramètre Cognitif | Baseline | Post-Traitement | Amélioration (%) | p-value |
|---|---|---|---|---|
| Rétention mémoire (30 sec) | 68.4 ± 12.1 | 81.7 ± 8.9 | +19.4% | p<0.001 |
| Rétention mémoire (5 min) | 52.8 ± 15.6 | 69.2 ± 11.4 | +31.1% | p<0.001 |
| Attention soutenue | 74.6 ± 9.8 | 86.3 ± 7.2 | +15.7% | p=0.003 |
5. CONSIDÉRATIONS DE SÉCURITÉ ET EFFETS INDÉSIRABLES
⚠️ ALERTE SÉCURITÉ : Syndrome Sérotoninergique
Le bleu de méthylène possède des propriétés d’inhibition de la monoamine oxydase (MAO-A) pouvant déclencher un syndrome sérotoninergique potentiellement mortel en association avec les inhibiteurs sélectifs de recapture de la sérotonine (ISRS), les inhibiteurs de recapture de la sérotonine-noradrénaline (IRSN), ou les antidépresseurs tricycliques.
La sécurité d’emploi du bleu de méthylène dépend fondamentalement de sa pureté et des interactions médicamenteuses. Le syndrome sérotoninergique peut survenir avec des doses aussi faibles que 0.7 mg/kg chez les patients sous traitement sérotoninergique concomitant. Cette interaction pharmacodynamique résulte de l’inhibition compétitive de la MAO-A par le bleu de méthylène, bloquant la dégradation de la sérotonine synaptique.
Les manifestations cliniques incluent l’hyperthermie (>40°C), l’hypertension artérielle sévère, les myoclonies généralisées, l’altération de l’état de conscience, et l’hyperréflexie. Le traitement nécessite l’arrêt immédiat du bleu de méthylène, la sédation par benzodiazépines, et l’administration de cyproheptadine (antagoniste sérotoninergique) à la posologie de 8 mg toutes les 6 heures.
5.1 Contre-indications Absolues
- Déficit en glucose-6-phosphate déshydrogénase (G6PD)
- Grossesse et allaitement (passage transplacentaire démontré)
- Hypersensibilité connue aux dérivés phénothiaziniques
- Insuffisance rénale sévère (clairance créatinine <30 ml/min)
- Traitement concomitant par ISRS, IRSN, ou IMAO
5.2 Surveillance Clinique Recommandée
L’administration de bleu de méthylène nécessite une surveillance clinique rapprochée, particulièrement lors de la première administration. Le monitoring inclut la prise de constantes vitales (pression artérielle, fréquence cardiaque, température) toutes les 15 minutes pendant la première heure, puis horaires pendant 6 heures.
Les effets indésirables fréquents (>10%) comprennent la coloration bleue-verte des urines (effet attendu, durée 24-48 heures), les nausées et vomissements (12-18% des patients), et les réactions au site d’injection pour les administrations intraveineuses. Ces effets sont généralement bénins et résolutifs spontanément.
Les effets indésirables graves (<1%) incluent l’hémolyse aiguë chez les patients G6PD-déficients, l’anémie hémolytique retardée, et exceptionnellement l’acidose lactique par dysfonction mitochondriale. Ces complications justifient la nécessité absolue d’utiliser uniquement du bleu de méthylène grade USP pour les applications médicales.
6. ANALYSE ÉCONOMIQUE ET DISPONIBILITÉ
L’analyse pharmacoéconomique révèle un paradoxe apparent : le coût d’acquisition du bleu de méthylène USP est 15 à 25 fois supérieur au grade standard, mais son impact économique global en santé publique demeure favorable. Le coût par dose thérapeutique (100 mg) s’élève à 45-65 euros pour le grade USP contre 2-4 euros pour le grade standard.
Cependant, l’analyse coût-efficacité intégrant les complications évitées, la réduction des échecs thérapeutiques, et la diminution des durées d’hospitalisation démontre un ratio coût-efficacité favorable au grade USP. Dans le traitement de la méthémoglobinémie, l’utilisation du grade USP réduit la durée moyenne de séjour de 18% (2.7 vs 3.3 jours) et diminue le taux de réadmission à 48 heures de 12.4% à 3.1%.
6.1 Fournisseurs Pharmaceutiques Agréés
La production mondiale de bleu de méthylène USP demeure concentrée entre quelques fabricants spécialisés. Provepharm (France) détient approximativement 40% du marché global avec sa technologie de purification brevetée, éliminant 99.5% des métaux lourds. Sigma-Aldrich (États-Unis) et Fagron (Belgique) complètent l’offre avec des productions certifiées FDA et EMA.
L’approvisionnement pharmaceutique fait face à des défis logistiques significatifs. La stabilité limitée des solutions préparées (6 mois à 2-8°C) et les exigences de chaîne du froid compliquent la distribution. Les ruptures de stock, récurrentes depuis 2020, ont motivé plusieurs initiatives de stockage stratégique au niveau des États membres européens.
7. PERSPECTIVES FUTURES ET RECHERCHE
Les développements futurs du bleu de méthylène s’orientent vers des formulations innovantes optimisant la biodisponibilité et la sélectivité tissulaire. Les nanoformulations lipidiques, actuellement en phase II clinique, promettent une amélioration de 300% de la pénétration de la barrière hémato-encéphalique, ouvrant des perspectives thérapeutiques inédites en neurologie.
La recherche en thérapie génique explore l’utilisation du bleu de méthylène comme vecteur de photosensibilisation pour l’activation contrôlée de gènes thérapeutiques. Cette approche « optogénétique » permettrait un contrôle spatio-temporel précis de l’expression génique, particulièrement prometteur en oncologie pour l’activation sélective de gènes pro-apoptotiques.
7.1 Applications Émergentes
Les applications cardiovasculaires font l’objet d’investigations intensives. L’étude BLUE-HEART (n=480 patients) évalue l’efficacité du bleu de méthylène dans la prévention du syndrome post-CEC (circulation extracorporelle), exploitant ses propriétés de stabilisation endothéliale et de réduction du stress oxydatif périopératoire.
En médecine régénérative, le bleu de méthylène démontre des propriétés stimulatrices de la prolifération des cellules souches mésenchymateuses. Cette découverte ouvre des perspectives en médecine esthétique pour la stimulation de la synthèse de collagène et l’amélioration de la texture cutanée, avec plusieurs essais cliniques en cours d’initiation.
8. CONCLUSION ET RECOMMANDATIONS PRATIQUES
L’analyse comparative exhaustive démontre sans équivoque la supériorité du bleu de méthylène grade USP sur le grade standard pour toutes les applications médicales. Cette supériorité ne se limite pas à la pureté chimique mais encompasse l’efficacité thérapeutique, la sécurité d’emploi, et la reproductibilité des résultats cliniques.
Les recommandations pratiques s’articulent autour de trois axes principaux : l’utilisation exclusive du grade USP pour tout usage médical, l’implémentation de protocoles de surveillance rigoureux, et la formation continue des équipes soignantes aux spécificités pharmacologiques de cette molécule centenaire aux applications contemporaines révolutionnaires.
L’avenir du bleu de méthylène s’inscrit résolument dans une démarche de médecine personnalisée, où la qualité pharmaceutique constitue le prérequis indispensable à l’innovation thérapeutique. La convergence entre tradition chimique et innovation clinique illustre parfaitement comment une molécule historique peut continuer à repousser les frontières de la médecine moderne.
Références Bibliographiques Sélectionnées
1. Ehrlich, P. (1891). Über die Methylenblaureaktion der lebenden Nervensubstanz. Deutsche Medizinische Wochenschrift, 17(1), 4-6.
2. Wright, R.O., et al. (1999). Methemoglobinemia: etiology, pharmacology, and clinical management. Annals of Emergency Medicine, 34(5), 646-656.
3. Tardivo, J.P., et al. (2005). Methylene blue in photodynamic therapy: From basic mechanisms to clinical applications. Photodiagnosis and Photodynamic Therapy, 2(3), 175-191.
4. Wischik, C.M., et al. (2015). Tau aggregation inhibitor therapy: an exploratory phase 2 study in mild or moderate Alzheimer’s disease. Journal of Alzheimer’s Disease, 44(2), 705-720.
5. Gonzalez-Rodriguez, E., et al. (2020). Methylene blue sentinel lymph node mapping in breast cancer: systematic review and meta-analysis. European Journal of Surgical Oncology, 46(11), 2021-2031.
